在所有生命领域中,蛋白质是由核糖体合成的,这个过程被称为翻译。翻译调控的整个幅度和强度超过了转录、mRNA降解和蛋白质降解的总和。因此,在全转录层面内研究RNA的翻译事件至关重要。翻译组测序最初是在酿酒酵母中研究,后来慢慢在很多物种中都有研究,人和小鼠研究最多。翻译组测序可以研究细胞内基因翻译的水平、区域、速率等,结合表观转录组、转录组、小RNA测序、蛋白组等进行关联分析,可以更精确地研究转录后调控、翻译调控机制。其中与目前研究热点RNA修饰结合应用最为经典,比如m6A、ac4C、m7G等热门RNA修饰的结合应用。因此,翻译组学已经将其独特和全新的角度全面扩展到包括蛋白质组学基础研究、肿瘤基础研究、细菌应激反应、生物节律、动物科学以及植物科学在内的许多领域。
目前,云序生物可提供两种翻译组测序:(1)Ribo-seq(Ribosome profiling sequencing核糖体印迹分析)和(2)Polysome-seq(多聚核糖体表达谱分析),可实现对与核糖体结合的正在翻译的RNA片段进行测序,准确获取样本中所有可翻译分子(包括mRNA和其他潜在可翻译RNA分子如lncRNA、circRNA等)的信息与精确定量。
那两种的测序方法的原理及分析差异分别是什么呢?可适用于什么研究场景呢?让小编带着各位一起学习一下吧~
翻译组学测序技术:
(1)Ribo-seq(Ribosome profiling sequencing)核糖体印迹分析
Ribo-seq是最常用的一种翻译组测序技术,首次由Ingolia等人在2009年发表。该技术通过利用RNA酶消化细胞中的RNA,以降解除受核糖体保护的RNA片段外的所有mRNA,得到被核糖体保护的正在翻译的RNA片段(ribosome
footprints,RFPs),然后对这些被核糖体保护的22-35nt左右的RNA片段进行富集、深度测序、分析,以揭示核糖体的位置和密度。
通过Ribo-seq可获得全基因组水平的蛋白翻译情况,发现新蛋白/短肽。同时,还可以和转录组数据联合计算RNA的翻译效率,或与蛋白组的数据联合分析瞬时翻译与蛋白累积的关系,分析蛋白的降解效应等。

由于Ribo-seq主要分析编码序列(CDS),即核糖体结合mRNA的区域,而对于与翻译调控高度相关的非翻译区(UTRs)不能有效分析。但Ribo-seq能得到结合到非编码RNA的“RFPs”,用于非编码RNA(如LncRNA)的翻译组学分析。另外,基于位置信息,还可以推断出每个转录本上的核糖体分布和密度,例如起始密码子的位置(包括非AUG启动)、密码子使用偏差、上游开放阅读框(uORFs)和翻译暂停事件全转录层面的景观。这些方面无法通过其他翻译组方法进行研究。
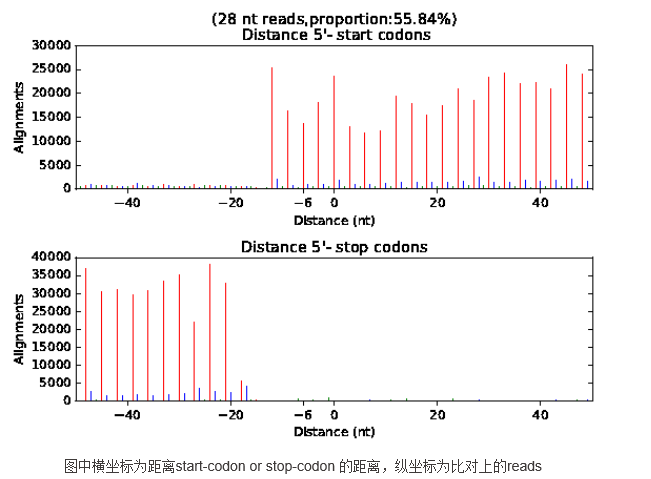
在翻译过程中,核糖体相对于RNA以密码子长度(3
nt)为单位移动。因此,以P位点为基准,来源于正常翻译过程的 RPF 片段应该在 RNA
上呈现3碱基的周期性分布。一般翻译起点在start-codon上游12nt,距离stop-codon 15nt 逐渐消失。这是判断一个
RNA是否被翻译的直接证据。
Ribo-seq样本要求:
样品类型:
动物组织、植物组织、细胞、菌类以及客户分离的RPF(核糖体复合物),其它类型样品请详询。
样品量:
细胞:4×107
细菌:4×107
动物组织:≥ 400mg
植物组织:≥ 400mg
其它类型样品用量请详询。
样品的运输与保存:
在简单处理并标记后,液氮速冻,-80℃冰箱保存,以避免实验操作前样品降解的可能性。干冰运输。
客户文章案例解析:
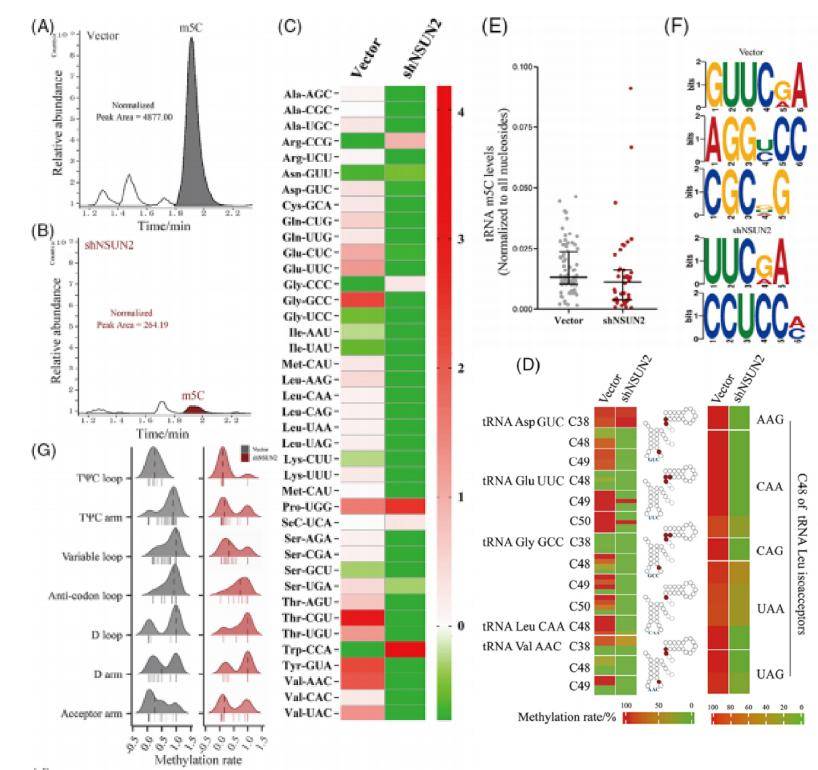
主题:m5C甲基转移酶NSUN2通过稳定间变性甲状腺癌中的tRNA来促进密码子依赖性的致癌翻译
原文:The m5C methyltransferase NSUN2 promotes codon-dependent oncogenic translation by stabilising tRNA in anaplastic thyroid cancer
期刊:Clinical and Translational Medicine 影响因子:10.4 发表日期:2023/11/13
研究先通过LC/MS&
m5C bis-seq整体评估了tRNA的m5C甲基化变化,发现tRNA
m5C甲基转移酶NSUN2在ATC中上调,并与去分化有关。且表型实验证明NSUN2下调抑制了ATC的形成、增殖、侵袭和迁移,增强了ATC对基因毒性药物的敏感性。结合ribo-seq
&
mRNA-seq等多组学手段,发现NSUN2催化tRNA的m5C修饰并调节tRNA的稳定性,m5C修饰水平的不同导致了密码子依赖性翻译偏倚。研究揭示了m5C甲基化转移酶NSUN2动态调控tRNA稳定性和下游致癌基因c-Myc触发的一种密码子依赖性致癌翻译网络,从而促进了ATC的形成。
(2)Polysome-seq(多聚核糖体表达谱分析)
Polysome
Profiling是在20世纪60年代基于蔗糖梯度超速离心法发展起来的。核糖体是大多数细胞中体积最大的大分子之一,具有高密度等特点,与较多的核糖体结合的mRNA分子能在蔗糖梯度中更快地沉降。因此,在经过蔗糖密度梯度离心后,诸多生物大分子由于密度不同,游离的RNA和蛋白质会漂浮在蔗糖梯度的顶部。从底部缓慢泵入蔗糖溶液,可以分离结合不同数量核糖体的mRNA。然后使用Northern
blot、基因芯片或RT-qPCR分析各部分中的mRNA,以反映转录本的翻译分布状况。由于Polysome-seq针对多聚核糖体mRNA进行分析,因此能够有效的分析非编码RNA的翻译或与翻译调控高度相关的非翻译区(UTRs)。
常见的多聚核糖体图谱正是利用了核糖体沉降系数较大的特性,用蔗糖密度梯度离心的方法将游离的RNA、40S核糖体小亚基、60S核糖体大亚基、经过组装的80S单核糖体以及结合有不同数目核糖体的mRNA分散到不同的蔗糖密度梯度溶液中。离心结束后用密度梯度分离仪将不同密度的蔗糖溶液从顶部由低浓度到高浓度收集到不同试管中,同时在OD254nm下吸光值。
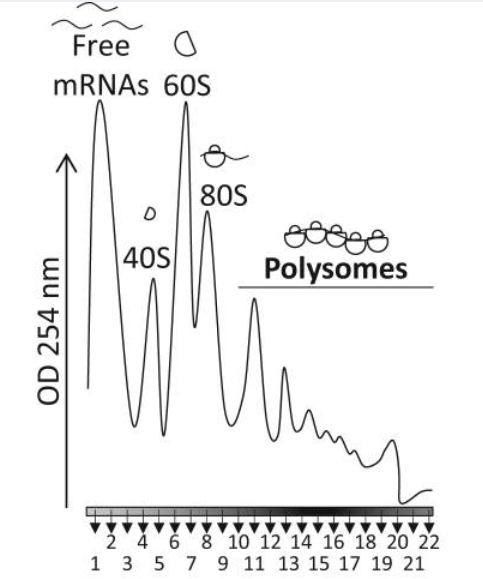
Polysome
Profiling这项技术通常用于检测翻译中发生巨大变化的RNA。例如,在高渗压下观察到单个核糖体组成的显著增加,在氧化应激下,单个mRNA结合的核糖体数量显著增加。需要注意的是,研究人员曾认为,通常活跃翻译的mRNA通常结合多个核糖体。然而,翻译对于结合单个核糖体的mRNA也是活跃的。例如,在被认为翻译非常活跃的HEK293细胞和菌落数量急剧增加的大肠杆菌(E.
coli)中,单个核糖体占比(原核生物的70S和真核生物的80S)占主导地位。当单个核糖体被分离并转移到无细胞翻译系统中时,核糖体可以恢复翻译事件并产生蛋白质。在酿酒酵母中,单个核糖体通常是正在进行延伸,而不是启动。短开放阅读框(ORFs)、快速翻译基因和低丰度mRNA倾向于富集或结合在单个核糖体中。这些结果证明了翻译活性与结合在mRNA上的核糖体数量并不成比例。
Polysome-seq样本要求:
样品类型:
动物组织、植物组织、细胞、菌类以及客户分离的多聚核糖体复合物,其它类型样品请详询。
样品量:
细胞:4×107
细菌:4×107
动物组织:≥ 400mg
植物组织:≥ 400mg
其它类型样品用量请详询。
样品的运输与保存:
在简单处理并标记后,液氮速冻,-80℃冰箱保存,以避免实验操作前样品降解的可能性。干冰运输。
高分文章案例解析1:
主题:QKI将m7G修饰转录本转运至应激颗粒并调节mRNA代谢
原文:QKI shuttles internal m7G-modified transcripts into stress granules and modulates mRNA metabolism
期刊:Cell 影响因子:45.5 发表时间:2023.7.20
此研究筛选并鉴定出mRNA内部m7G修饰的首个识别蛋白QKI
(Quaking),而且报道了在应激状态下QKI对细胞应激颗粒内具有m7G修饰mRNA的动态调控作用。研究者通过高通量测序综合分析了应激状态下m7G
meRIP-seq、QKI7 RIP-seq以及SG RNA-seq的数据,结果显示Quaking蛋白(QKIs)优先识别内部mRNA
m7G修饰。接下来研究者开展了mRNA稳定性检测和Polysome
profiling,结果表明在应激状态下QKI可以调控Hippo信号通路关键基因等靶基因的稳定性和翻译效率。
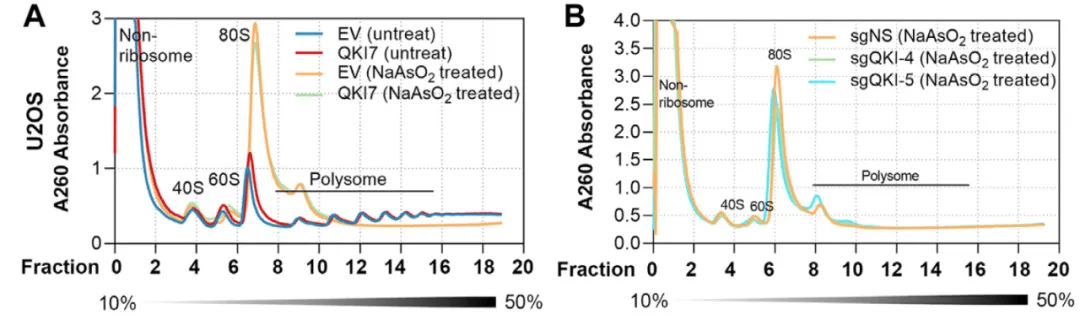 Polysome profiling显示QK17过表达或删除对翻译效率无显著影响
Polysome profiling显示QK17过表达或删除对翻译效率无显著影响
高分文章案例解析2:
主题:tRNA m7G修饰通过RPTOR/ULK1/自噬轴促进食管鳞癌发展
原文:N7-methylguanosine
tRNA modification promotes esophageal squamous cell carcinoma
tumorigenesis via the RPTOR/ULK1/autophagy axis
期刊:Nat Commun 影响因子14.7 发表时间:2022.3.18
此研究证实了METTL1和WDR4在食管鳞癌(ESCC)中显著上调,并与ESCC预后不良相关。从机制上,研究者证明了tRNA
m7G修饰通过调控m7G相关密码子富集mRNA的翻译,包括mTOR和自噬通路基因的负调控因子,为ESCC治疗靶向药物的开发提供线索。对METTL1敲降细胞以及对照细胞采用Polysome-seq计算了mRNA上的m7G
tRNA所对应的密码子的数量。结果显示,mRNA上越多,翻译效率(TE)降低的mRNA具有明显更多的由m7G tRNA所对应的密码子。
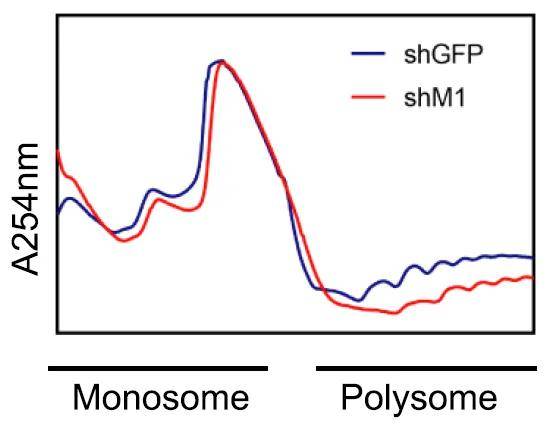 多聚核糖体峰图
多聚核糖体峰图
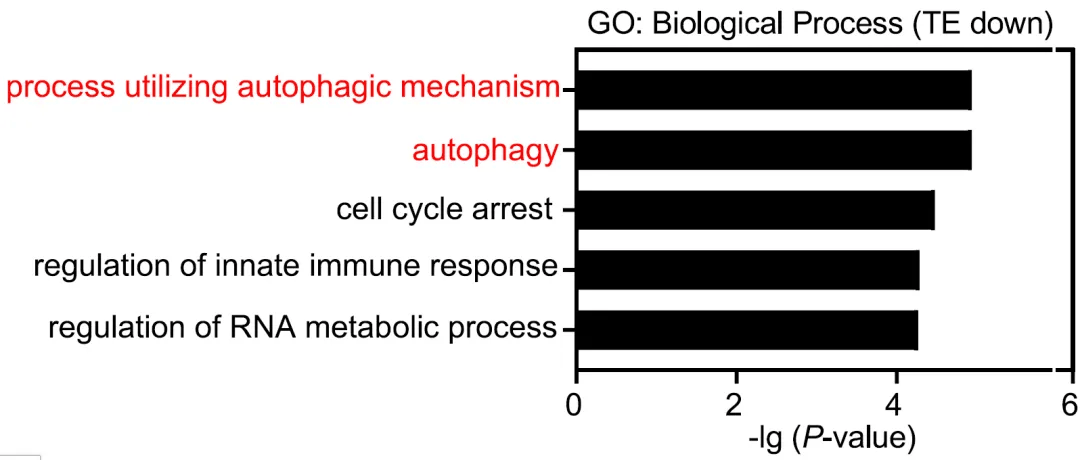 差异翻译效率基因GO分析
差异翻译效率基因GO分析
基于以上分享,我们发现Ribo-seq&Polysome-seq两种方法都可以跟RNA-seq进行联合分析,同时还能与表观转录修饰组学(MeRIP-seq)进行联合分析,探究修饰对基因表达及翻译的影响。
从目前已发表文章来看,Ribo-seq的应用更加广泛,发文数量也比较多。且从实验处理方面来看,Ribo-seq的步骤相对简单。如果您的研究课题不涉及circRNA的翻译能力机制研究,可以优先选择Ribo-seq。
转自:云序生物